| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 |
- ion implantation
- feol
- GIDL
- oxidation
- 반도체공정
- She
- high bandwidth memory
- 반도체 8대공정
- 반도체소자
- 선결함
- mechanism
- 부피결함
- 양자역학
- Warpage
- MOSFET
- Short Channel Effect
- RCAT
- DRAM
- finFET
- SOI MOSFET
- 반도체공학
- Punch through
- Threshold Voltage
- effective mass
- Energy Band
- Dynamic Random Access Memory
- Silicon on Insulator
- doping
- SK하이닉스
- HBM
- Today
- Total
반도체 공부 기록
[반도체공정(FEOL)] Oxidation #01 - Deal Grove model 본문
Oxidation
반도체 소자에서 다양한 역할을 맡고 있는 SiO2에 대해서 알아보도록 하겠습니다.
♭ SiO2

SiO2는 실리콘(Si)을 중심으로 사면체(Tetrahedron) 꼭짓점에 산소(O)가 인접하고 있는 3차원 망상 구조를 가지고 있다. 우수한 절연 특성(비저항: 1020 Ω cm 이상, Eg: 8~9eV, Breakdown: 10MV/cm 이상)을 가지고 있어 반도체 소자에서 절연막(Isolation)에 사용된다. 또, 반도체 소자에 주로 사용되는 실리콘 웨이퍼에서 산소 소스만 공급하면 안정한 SiO2를 형성할 수 있어(Si-SiO2 계면 특성 우수) MOSFET의 Gate oxide로도 활용한다. (유전율: 약 3.9)
그 밖에도 반도체 기판에 국부적으로 도핑하기 위해 원하지 않은 부위에 Dopant가 주입되지 않도록 Mask 역할을 수행할 수 있으며, 추후에 다룰 식각(Etch) 공정에서도 Si/SiO2 식각 선택비가 우수하다는 장점이 있다.
*식각 선택비(Etch selectivity)
식각하고자 하는 물질과 그렇지 않은 물질의 식각 정도의 비율로, 식각 선택비가 클수록 식각하고자 하는 물질은 잘 제거가 되고 그렇지 않은 물질은 식각이 잘 되지 않는 것을 의미한다. 자세한 내용은 추후 식각 공정에서 다루도록 하겠습니다.
♭ Oxidation

SiO2를 형성하는 다양한 방법 중 산화(Oxidation)에 대해 알아보도록 하겠습니다. 산화 공정은 실리콘 웨이퍼에 산화제(O2, H2O)와 열을 공급하여 산화막을 성장(Growth)하는 방법이다. 산화 공정은 SiO2를 형성하는 다른 방법과 다르게 실리콘 웨이퍼를 소모하면서 산화막을 성장시킨다. (PVD, CVD 방식은 실리콘 웨이퍼를 소모하지 않고 SiO2 산화막 자체를 쌓는다(증착한다; Deposite))
산화 공정은 Furnace(로)에 산화제를 주입하고 가열하여 산화막을 성장한다. 산화제를 제외하고도 여러 소스들이 주입되는데 간략하게 알아보도록 하겠습니다.

1. N2 : Chamber 분위기를 비활성화 → 산화 반응을 제외한 화학 반응 억제
2. O2 : 산화제 → 산화 공정을 진행
3. H2 : 산화제 → 산화 공정을 진행
(산화제로 사용하는 H2O는 H2와 O2를 개별적으로 조성을 맞추어 공급한다.)
4. N2 : Carrier gas → 산화제 가스를 Chamber 이동시키기 위한 매개체 가스
5. HCl: Dry oxidation에서는 H를 공급하여 산화 속도를 개선시키고, HCl의 Cl은 불순물을 제거(산화막 퀄리티 개선)
6. TCA(C2H2Cl3) : 산화막 퀄리티 개선
♭ Deal-Grove model (증명)
산화 공정으로 산화막이 성장 메커니즘에 대해 알아보도록 하겠습니다.
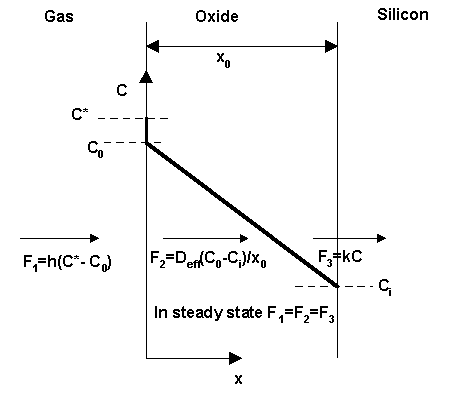
Deal-Grove model은 시간에 따라 변화가 없는 정상 상태(Steady state) 이므로 F1 = F2 = F3를 만족한다.
1. F1은 Furnace에서 공급되는 산화제 가스가 실리콘 기판 표면으로 이동하는 유량(속도)을 의미한다.
$$ F_{1} = h_{g}(C^*-C_{0}) $$
hg : 질량 전달 계수, C* : Gas phase에서의 산화제 농도 C0 : 실리콘 기판 표면에서의 산화제 농도
1) Henry 법칙에 의해 C0 = HPs, C*=HPG 이다.
2) 이상 기체 방정식에 의해 CG = PG/kT, Cs = Ps/kT 이다.
2. F2는 SiO2 표면에서 SiO2/Si 계면으로 산화제 가스의 유량(속도)을 의미한다.
→ Fick's law에 의해 다음과 같은 수식으로 정리 할 수 있다.
$$ F_{2} = \frac{D(C_{0}-C_{i})}{X_{0}} $$
D : 산화제 가스의 SiO2 내의 유효 확산 계수 (Effective diffusivity) X0 : SiO2의 두께
3. F3는 SiO2/Si 계면에서 산화제 가스가 Si과 반응(속도)을 의미한다.
$$ F_{3}=K_{s}C_{i} $$
Ks : 표면 반응 속도
F1 = F2 = F3 이므로 다음과 같이 정리 할 수 있다.
$$ C_{i} = \frac{C^{*}}{1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}}, C_{0}=\frac{(1+\frac{K_{s}X_{0}}{D})C^{*}}{1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}} $$
| 1) F2 = F3 $ \frac{D(C_{0}-C_{i})}{X_{0}} = K_sC_i \to \frac{D}{X_{0}}C_{0} = C_{i}(K_{s}+\frac{D}{X_{0}}) $ $ \therefore C_{0}=C_{i}(\frac{K_{s}X_{0}}{D}+1) $ 2) F1 = F2 $ h(C^{*}-C_{0})=K_{s}C_{i} $ → $ C^{*}=\frac{K_{s}}{h}C_{i} + C_{0} = \frac{K_{s}}{h}C_{i} + (1+\frac{K_{s}X_{0}}{D})C_{i} = C_{i}(1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}) $ → $ C_{i} = \frac{C^{*}}{1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}}, C_{0}=\frac{(1+\frac{K_{s}X_{0}}{D})C^{*}}{1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}} $ |
♭ Deal-Grove model (해석)

1) Diffusion controlled growth : D ; small, Ci → 0 and C0 → C*
→ 확산 속도(Diffusion rate) < 표면 반응 속도 (Surface-reaction rate)이므로 산화율(Oxidation rate)는 확산에 의해 결정된다.
2) Surface-reaction controlled growth : D ; large, C ≈ C0 = C*/(1 + Ks/h)
→ 확산 속도(Diffusion rate) > 표면 반응 속도 (Surface-reaction rate)이므로 산화율(Oxidation rate)는 표면 반응에 의해 결정된다.
♭ 산화막 성장 속도

$$ G = \frac{dX_{0}}{dt}, F=N\frac{dX_{0}}{dt}=\frac{K_{s}C^{*}}{1+\frac{K_{s}}{h}+\frac{K_{s}X_{0}}{D}} $$
N : 산화막의 단위 부피 내에 포획되는 산화제의 분자수
미분 방정식을 풀이하면, $ X_{0}^{2} + AX_{0} = B(t + \tau ) $ 이다.

$\tau = \frac{X_{i}^{2}+AX_{i}}{B}, X_{i}=X_{0}(0), A = 2D(1/K_{s}+1/h), B = \frac{2DC^{*}}{N},\frac{X_{0}}{A/2}=(1+\frac{t+\tau }{A^{2}/4B})^{1/2}-1$
1) t + τ >> A2/4B → X02 = B (t + τ) (B : Parabolic growth constant) : Dependent D
: 산화 공정 시간이 길어지면 Parbolic growth constant B에 의존한다. → 성장한 산화막의 두께가 증가하므로 두꺼워진 산화막을 통과하는 확산 속도가 Si/SiO2 계면에서 반응하는 속도보다 느리기 때문에 산화막 성장속도는 확산에 의존한다.
2) t + τ << A2/4B → X0 = B/A (t + τ) (B/A : Linear growth constant) : Independent D
: 산화 공정 시간이 짧아지면 Linear growth constant B/A에 의존한다. → 성장한 산화막의 두께가 얇기 때문에 산화막을 통과하는 확산 속도가 Si/SiO2 계면에서 반응하는 속도보다 빠르기 떄문에 산화막 성장속도는 표면 반응에 의존한다.
<출처>
B. E. Deal, A. S. Grove, "General Relationship for the Thermal Oxidation of Silicon", J. Appl. Phy., 36 (1965) 3770-3778.
오류가 있다면 피드백 남겨주시면 감사하겠습니다.
'반도체 전공정(FEOL)' 카테고리의 다른 글
| [반도체공정(FEOL)] Oxidation #03 - Application (2) | 2024.06.03 |
|---|---|
| [반도체공정(FEOL)] Oxidation #02 - Oxidation variable (0) | 2024.05.29 |
| [반도체공정(FEOL)] Wafer fabrication #03 (0) | 2024.05.23 |
| [반도체공정(FEOL)] Wafer fabrication #02 (0) | 2024.05.22 |
| [반도체공정(FEOL)] Wafer fabrication #01 (0) | 2024.05.22 |




