| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 |
- Short Channel Effect
- SOI MOSFET
- She
- HBM
- mechanism
- Threshold Voltage
- Punch through
- Silicon on Insulator
- Energy Band
- MOSFET
- DRAM
- 반도체공학
- 부피결함
- RCAT
- 선결함
- ion implantation
- oxidation
- finFET
- high bandwidth memory
- 반도체 8대공정
- Dynamic Random Access Memory
- doping
- 양자역학
- feol
- effective mass
- 반도체공정
- Warpage
- 반도체소자
- GIDL
- SK하이닉스
- Today
- Total
반도체 공부 기록
[반도체공학] 01. The crystal structure of solids (1) 본문
The Crystal Structure of Solids
♭ 반도체(Semiconductor)란?
반도체는 전기 전도도가 도체와 반도체의 중간 정도의 해당하는 물질
1) 도체와 부도체와 다르게 전기 전도도가 고정되어 있지 않다.
→ 인가 전압, 열, 파장에 의해 전기적 특성이 변한다. (저온: 부도체, 고온: 도체)

2) 반도체는 14족 원소(Si, Ge) 또는 13족-15족(GaAs)/2족-16족(ZnO) 원소로 구성
→ Elemental semicondutor: 단일 원소로 이루어진 반도체
Compound semiconductor: 두 가지 이상의 원소로 이루어진 반도체
3) 반도체(소자)는 전류의 흐름을 조절할 수 있다.
→ 도핑 농도를 통해 반도체의 전기 전도도를 조절할 수 있다.
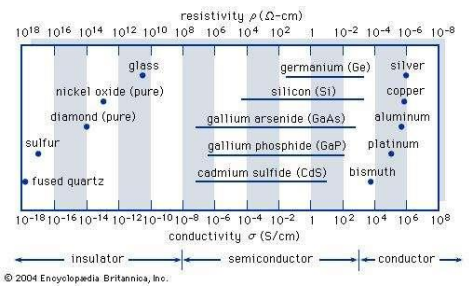
반도체는 도체/부도체와 다르게 도핑(Doping)을 통해 전기 전도도(비저항)을 조절할 수 있기 때문에 범위로 표현된다.
♭ 물질의 결정성: 원자 배열에 따라 물질의 결정성이 달라진다.

1) 단결정(Single crystal): 고체 전 범위에 일정한 주기를 갖고 있는 물질
→ Mobility가 높고, 해석이 용이하다.
2) 비정질(Amorphous) : 고체 전 범위에서 일정한 주기를 갖고 있지 않은 물질
→ Mobility가 낮고, 해석이 어렵다
3) 다결정(Poly-crystal): Grain 내부에만 일정한 주기를 갖고 있는 물질
♭ 격자 구조(Lattice structure)
-Unit cell
고체 재료 내부에서 규칙적인 구조를 나타내는 단위
-Primitive cell
고체 재료 내부에서 반복되는 최소의 구조 → 가장 작은 Unit cell을 의미한다.
-Basic lattice structure
Cubic 형태를 갖는 기본적인 격자 구조는 Simplc cubic, BCC(Body-Centered Cubic), FCC(Face-Centered Cubic)이 있다. 기본적인 3가지 격자구조를 포함하여 모든 고체 재료는 14가지의 격자 구조로 분류할 수 있는데, 이를 Bravais lattice라고 한다.
| Simple cubic | BCC(Body-Centered Cubic) | FCC(Face-Centered Cubic) | |
| Figure |  |  |  |
| # of atoms in unit cell | 8 × ⅛ = 1 | (1 × 1) + (8 × ⅛) = 2 | (8 × ⅛) + (6 × ½) = 4 |
| CN(Coordination number) | 6 | 8 | 12 |
| APF(Atomic packing factor) | 0.52 | 0.68 | 0.74 |
| Example | Polonium(Po) | Iron(α-Fe), Tungsten(W) | Iron(γ-Fe), Copper(Cu) |
<Bravais lattice> | |||
-Semiconductor lattice
| Diamond structure | Zinc blende | Wurzite structure | |
| Figure |  |  |  |
| # of atoms in unit cell | (1 × 4) + (8 × ⅛) + (6 × ½) = 8 | (1 × 4) + (8 × ⅛) + (6 × ½) = 8 | (1 × 2) + (6 × ⅙) + (4 × 1⁄12) = 4 |
| CN(Coordination number) | 4 | 4 | 4 |
| APF(Atomic packing factor) | 0.34 | - | - |
| Example | C(Diamond), Si, Ge | GaAs, InP | ZnO, ZnS |
♭ 원자 결합(Atomic bonding)
18족 원소를 제외한 모든 원자들은 다른 원자들고 결합하는 것이 에너지적으로 안정하다.
1) 금속 결합(Metallic bonding)
금속 원자 사이의 결합
→ 전자바다: 전자가 자유롭게 이동할 수 있는 형태로 금속 물질이 전도성을 갖는다.
Ex) Fe, Al, Ga
2) 공유결합(Covalent bonding)
비금속 원자 사이의 결합
→ 전자를 공유하여 옥텟 규칙을 만족시킨다.
Ex) HF, HCl
3) 이온결합(Ionic bonding)
금속 원자와 비금속 원자가 결합하는 방식
→ 금속은 전자를 잃어 양이온, 비금속 원자는 전자를 얻어 음이온으로 거동한다.
Ex) NaCl, FeO
<출처>
Donald A. Neaman, "Semiconductor physics and device" 4th edition.
D. V. Anghel, "Barvaus Lattice Table" (2003).
오류가 있다면 지적해주시면 감사하겠습니다 :)
'반도체공학' 카테고리의 다른 글
| [반도체공학] 06. Introduction to Quantum mechanism (4) (2) | 2024.02.24 |
|---|---|
| [반도체공학] 05. Introduction to Quantum mechanism (3) (0) | 2024.02.23 |
| [반도체공학] 04. Introduction to Quantum mechanism (2) (0) | 2024.02.22 |
| [반도체공학] 03. Introduction to Quantum mechanism (1) (0) | 2024.02.20 |
| [반도체공학] 02. The crystal structure of solids (2) (4) | 2024.02.19 |




